Tema: Esclerose Múltipla
1. Etiologia e patogênese
Caracteriza-se por áreas de desmielinização localizada disseminadas no cérebro e na medula espinal. Os sintomas comuns são: anormalidades visuais e oculomotoras, parestesias, fraqueza, espasticidade, disfunção urinária e sintomas cognitivos leves. Tipicamente, os deficits neurológicos são múltiplos, com remissões e exacerbações, levando gradualmente à incapacidade. O diagnóstico requer evidências clínicas ou RM de ≥ 2 lesões neurológicas características separadas tanto no tempo como no espaço (localização no sistema nervoso central). O tratamento é feito com corticoides nas crises, imunomoduladores para prevenir as exacerbações e medidas de suporte.
Acredita-se que a esclerose múltipla envolva um mecanismo imunológico. Uma causa postulada é a infecção por um vírus latente (possivelmente um herpes-vírus humano, como o Epstein-Barr) que, quando ativado, desencadeia a resposta autoimune secundária.
A doença é mais comum em indivíduos que passaram seus primeiros 15 anos de vida em climas temperados (1/2.000) do que naqueles que os passaram em climas tropicais (1/10.000). Uma explicação é de que níveis mais baixos de vitamina D estejam correlacionados ao aumento do risco de EM e as concentrações de vitamina D se correlacionam ao grau de exposição a luz solar, que é menor em climas temperados. O tabagismo também parece elevar o risco.A idade de início varia de 15 a 60 anos, tipicamente de 20 a 40 anos; as mulheres costumam ser um pouco mais afetadas.
Ocorrem áreas localizadas de desmielinização (placas), com destruição da oligodendróglia, inflamação perivascular e alterações químicas nos constituintes lipídicos e proteicos da mielina, dentro e ao redor das placas. Dano axonal é comum, e os corpos celulares neuronais também podem morrer ou ser danificados.
Há desenvolvimento de gliose fibrosa nas placas que são disseminadas pelo sistema nervoso central, principalmente na substância branca, em particular nas colunas laterais e posteriores (especialmente nas regiões cervicais), nervos ópticos e áreas periventriculares. Os tratos no mesencéfalo, ponte e cerebelo também são afetados. A substância cinzenta no cérebro e na medula espinal pode ser afetada, mas em extensão muito menor.
2. Desenvolvimento Embriológico do Sistema Nervoso Central (SNC)
O desenvolvimento do Sistema Nervoso no Desenvolvimento Embrionário tem início na Terceira Semana. A Ectoderma (Folheto Embrionário) induzido pela Notocorda começa a se espessar formando uma estrutura chamada Placa Neural no processo denominado Neurulação. Posteriormente sofrerá elevações em suas extremidades formando as Pregas Neurais (precursoras do SNP e SNA) que mais a frente irão se fusionar em sentido cranial-caudal, assim originando um canal nomeado “Tubo Neural”(Precursor do SNC). Há uma parte das pregas neurais que se desprende ficando entre o ectoderma e o tubo neural, as denominadas Cristas Neuraisn(Precursoras do SNP).
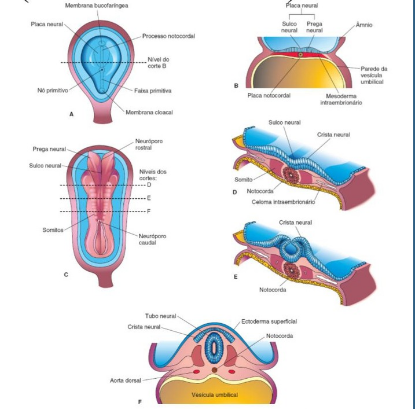
Fonte: Moore, 2024
Cada extremidade irá originar estruturas diferentes do SNC, sendo a extremidade cranial pelo encéfalo e caudal pela medula espinal, e é também por isso que malformações do encéfalo quanto a medula espinal estão diretamente ligadas com o desenvolvimento dessas duas porções do tubo neural. Após o fechamento completo das extremidades, antes abertas, cranial e caudal do Tubo neural (Neuróporos), a região cefálica do embrião irá apresentar 3 vesículas encefálicas primárias: O prosencéfalo, mesencéfalo e rombencéfalo. Essas vesículas originaram outras estruturas.
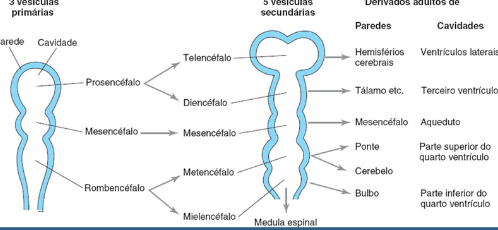
Fonte: Moore, 2024
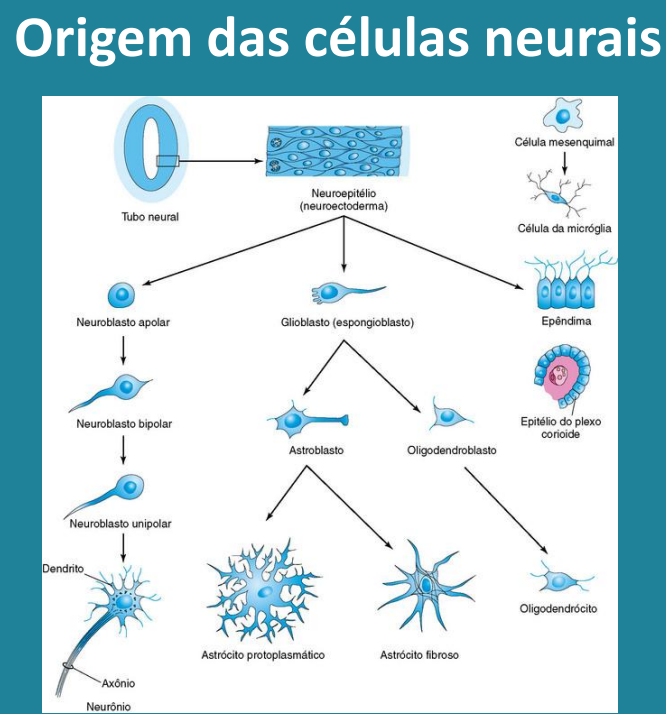
3. Formação da Bainha de Mielina no Processo Embrionário
- Origem das Células Progenitoras Oligodendroblastos
Durante o desenvolvimento embrionário, as células progenitoras oligodendroblasto se originam a partir de células-tronco neurais na região do tubo neural. Estas células progenitoras são precursoras dos oligodendrócitos, que são as células responsáveis pela produção da mielina. - Proliferação e Migração
Após sua formação, as células progenitoras oligodendrogliais proliferam e migram para as regiões do SNC onde a mielinização ocorrerá. Essa migração é guiada por sinais químicos e interações com outras células do SNC. - Diferenciação em Oligodendrócitos
Uma vez que as células progenitoras alcançam o local adequado, elas se diferenciam em oligodendrócitos maduros. Esse processo de diferenciação envolve mudanças morfológicas e funcionais nas células, permitindo que elas se especializem na produção de mielina. - Formação da Mielina
Os oligodendrócitos amadurecidos começam a formar a bainha de mielina ao redor dos axônios dos neurônios. A mielina é composta principalmente por lipídios e proteínas. O processo de mielinização segue estas etapas:- Envolvimento do Axônio: O oligodendrócito estende seus processos ao redor do axônio. Cada oligodendrócito pode mielinizar vários axônios simultaneamente.
- Espessamento da Mielina: As membranas do oligodendrócito se enrolam em torno do axônio em várias camadas, formando a bainha de mielina. Isso ocorre por meio da fusão das membranas celulares do oligodendrócito, criando camadas concêntricas ao redor do axônio.
- Compactação da Mielina: As camadas de membrana se compactam, formando uma estrutura densa que isola o axônio. Isso é essencial para a condução rápida dos impulsos elétricos.
- Desenvolvimento e Função
A mielinização é um processo gradual que começa no terceiro trimestre da gestação e continua após o nascimento. A formação de mielina é crucial para a eficiência da condução dos impulsos nervosos, afetando a coordenação motora e as funções cognitivas. - Regulação e Controle
A formação da mielina é regulada por uma série de fatores, incluindo sinais moleculares e interações celulares. Fatores de crescimento e citocinas desempenham papéis importantes na diferenciação e função dos oligodendrócitos.
Importância da Mielinização
A mielina é essencial para a condução eficiente dos impulsos nervosos ao longo dos axônios. Sem uma bainha de mielina adequada, a condução dos impulsos pode ser lenta e ineficiente, levando a uma série de distúrbios neurológicos e problemas de desenvolvimento. A mielinização adequada é, portanto, crucial para o desenvolvimento normal do SNC e para a função neural ao longo da vida.
- Histologia normal do tecido nervoso
O tecido nervoso é composto por pouquíssima quantidade de matriz extracelular, quando comparado a outros tipos de tecidos, e por células nervosas que, basicamente, podem ser de dois tipos: os neurônios, que são as células responsáveis pela transmissão do impulso nervoso, e as células da glia, que desempenham função de suporte e manutenção dos neurônios.
-
- Neurônios
-
-
- Responsáveis pela recepção, transmissão e processamento de estímulos;
- Possuem uma morfologia complexa, mas apresentando pelo menos 3 componentes:
-
-
-
- Dendritos: prolongamentos especializados em receber estímulos do meio ambiente, de células epiteliais sensoriais ou de outros neurônios;
- Corpo celular ou pericário: centro trófico da célula e também apto a receber estímulos;
- Axônio: prolongamento único especializado na transmissão do impulso nervoso dos neurônios para outras células.
-
-
-
- De acordo com a sua forma, podem ser classificados nos seguintes tipos:
-
-
-
- Multipolares: apresentam mais de dois prolongamentos celulares;
- Bipolares: possuem apenas dois prolongamentos celulares, um dendrito e um axônio;
- Pseudounipolares: apresentam apenas um prolongamento próximo ao corpo celular, mas que logo se divide em dois ramos.
-
-
- Células da glia
-
-
- Oligodendrócitos: responsáveis pela produção da bainha de mielina nos axônios de neurônios do sistema nervoso central;
- Células de Schwann: possuem a mesma função dos Oligodendrócitos, porém no sistema nervoso periférico;
- Astrócitos: células em forma de estrela com múltiplos prolongamentos irradiando do corpo celular. São responsáveis pela nutrição dos neurônios, pelo controle da composição iônica e molecular do meio extracelular do tecido nervoso, pela regulação e influência na atividade dos neurônios e de outras células gliais, pela emissão de prolongamentos com dilatações que compõem a barreira hematoencefálica, protegendo o sistema nervoso de possíveis agentes infecciosos;
- Células ependimárias: são células colunares que revestem os ventrículos do cérebro e o canal central da medula espinhal; além de produzirem o líquido cefalorraquidiano (LCR) – responsável pela proteção, nutrição e remoção de resíduos do SNC – também são ciliadas em alguns locais, facilitando a movimentação desse líquido.
- Micróglia: funcionam como células imunológicas do sistema central, atuando na defesa contra patógenos e na remoção de detritos celulares do SNC.
-
Bainha de mielina
É uma substância de caráter lipídico que envolve os axônios, formando uma camada isolante que aumenta a velocidade de propagação dos impulsos nervosos.
Sua estrutura é composta por:
Camadas de mielina: Forma múltiplas camadas de membranas celulares em fibras mielínicas ou somente uma camada nas fibras amielínicas. No sistema nervoso central (SNC), as camadas são produzidas pelos oligodendrócitos, enquanto no sistema nervoso periférico (SNP), são produzidas pelas células de Schwann.
Nódulos de Ranvier: são intervalos regulares na mielina ao longo do axônio onde a membrana axonal fica exposta. Esses nódulos são de grande importância para a condução saltatória, onde o impulso nervoso “salta” de um nódulo para o outro, aumentando a velocidade de propagação desse sinal. Não estão presentes em fibras amielínicas que possuem uma camada de mielina contínua.
4. Alterações histológicas
O tecido neural patológico apresenta infiltração perivenosa de linfócitos, plasmócitos e macrófagos, que rompem a barreira hematoencefálica e entram no SNC, onde iniciam seu ataque à mielina.
Ocorre a perda de oligodendrócitos e astrocitose, gerando inflamação ao longo dos nervos onde a mielina está sendo danificada.
A micróglia pode se tornar hiperativa, induzindo a secreção de moléculas tóxicas que danificam as células nervosas.
As áreas de mielina danificadas ficam com cicatrizes e não podem mais isolar totalmente o nervo – deixando áreas desprotegidas, onde o fluxo de impulsos nervosos é interrompido.
Foram detectadas placas de desmielinização de distribuição assimétrica e aleatória, localizadas predominantemente na substância branca cerebral, núcleos cinzentos basais, hipocampo, tronco cerebral e medula espinhal. Estas placas apresentam confluência, com contornos ora nítidos, ora pouco precisos e no seu interior apresentam astrogliose de discreta a acentuada, macrófagos espumosos e proliferação de oligodendrócitos, com placas em graus variados de atividade.
Ademais, tais placas são muitas das vezes centradas por vênulas, que exibiam infiltrado linfohistiocitário perivascular.
5. Técnicas de Microscopia na pesquisa da Esclerose Múltipla
As técnicas de microscopia desempenham um papel crucial na pesquisa sobre Esclerose Múltipla (EM), fornecendo insights detalhados sobre a patologia e a progressão da doença. Através dessas técnicas, os pesquisadores conseguem analisar com precisão as alterações estruturais e funcionais associadas à EM.
- Microscopia de Fluorescência Multifotônica (MFM) é particularmente valiosa para visualizar estruturas neurais profundas e identificar alterações na mielina e nos marcadores inflamatórios. Essa técnica permite a obtenção de imagens de alta resolução de tecidos biológicos espessos e a monitorização de processos patológicos em tempo real (Kwan et al., 2020).
- Microscopia de Fluorescência de Excitação Única (Confocal) oferece imagens detalhadas das lesões de mielina e das células imunológicas envolvidas na EM, ajudando a mapear a extensão das lesões e a atividade inflamatória (Wang et al., 2017).
- Microscopia de Imagem por Tomografia (OCT), por sua vez, é essencial para a análise da espessura da camada de fibras nervosas da retina, que serve como um marcador importante da atividade da doença e da sua progressão (Pereira et al., 2019).
As técnicas de Microscopia Eletrônica fornecem uma visão detalhada das alterações ultrastruturais na mielina e nas células nervosas. A **Microscopia Eletrônica de Transmissão (TEM)** permite a visualização das mudanças na estrutura da mielina e a **Microscopia Eletrônica de Varredura (SEM)** revela alterações na superfície das amostras de tecido cerebral, contribuindo para a compreensão das lesões de desmielinização (Frischer et al., 2009; Lassmann et al., 2012).
Finalmente, a Microscopia de Polarização pode ser utilizada para observar a estrutura da mielina e a organização dos axônios, ajudando a identificar lesões e áreas de desmielinização com maior clareza (Trapp et al., 2018).
Essas técnicas são fundamentais para a compreensão detalhada da Esclerose Múltipla, fornecendo dados críticos para o desenvolvimento de novos tratamentos e a melhoria das abordagens terapêuticas.
6. Perspectivas terapêuticas
As terapias existentes apresentam foco principal na imunomodulação e controle dos sintomas. Assim, requer abordagens inovadoras que enfrentem as causas subjacentes e forneçam soluções mais direcionadas.
O uso dos moduladores de receptores de esfingosina-1-fosfato (S1P), mostrou redução significativa na taxa anualizada de surtosem pacientes com EM recorrente, apresentando eficácia no uso de ozanimode e ponesimode. Este método funciona através da ação do modulador de liga-se seletivamente em dois dos cinco receptores (S1P1 e S1P5), evitando a saída dos linfócitos dos linfonodos e impedindo que as células que causam inflamação cheguem ao cérebro e na medula espinhal, desacelererando os efeitos da atividade da doença. Contudo, esses moduladores apresentam efeitos colaterais, como o edema macular, bradicardia e bloqueio atrioventricular, exigindo monitoramento cuidadoso e seleção criteriosa de pacientes. Ademais, a descontinuação abrupta do fingolimode pode resultar em recaídas acentuadas.
O transplante autólogo de células-tronco hematopoiéticas (aHSCT) apresenta-se como um avanço promissor, oferecendo a possibilidade de um tratamento para pacientes com formas refratárias e graves de EM. Por mais que a aHSCT apresente riscos significativos, sua eficácia comprovada em estudos anteriores sugere um potencial impacto positivo na gestão da doença.
Inibidores da tirosina quinase de Bruton (BTK), como fenebrutinibe e tolebrutinibe, apresentam potencial no tratamento da Esclerose Múltipla (EM). Funcionam através da ligação à proteína BTK, bloqueando a atividade dessa proteína pela ativação de BTK induzida por BCR e sua sinalização a jusante. Assim, promovem a inatividade do crescimento das células B causando a morte celular das células B malignas. Esses inibidores demonstram benefícios ao modular o desenvolvimento de células B e a ativação de células T, oferecendo um perfil de risco potencialmente mais favorável.
O uso de agentes anti-células B, sobretudo os anticorpos monoclonais (mAbs) como o rituximabe e o ocrelizumabe. Esses fármacos, classificados como anti-CD20 de 1ª e 2ª gerações, demonstraram considerável sucesso na redução de recaídas e lesões, especialmente em formas recorrentes da EM. O rituximabe, amplamente utilizado mesmo de forma off-label, e o ocrelizumabe, aprovado pela FDA, surgem como opções terapêuticas eficazes, com destaque para o último em estudos de fase 3. Além disso, a emergência de moléculas menores, como o evobrutinibe, que atua como inibidor de BTK, promete inovação ao superar a barreira hematoencefálica.
7. Inovações em pesquisa para o tratamento
Oferecendo tratamentos mais eficazes, com menos efeitos colaterais e melhor qualidade de vida, essas inovações estão proporcionando novas esperanças para os pacientes com esclerose múltipla
– Terapias Modificadoras da Doença (DMTs): com medicamentos de nova geração e tratamentos que atacam células B específicas estão em alta. Eles são eficazes em reduzir as inflamações associadas à EM.
– Terapias de Reposição de Mielina: terapias que incentivam o reparo da mielina danificada. Medicamentos como o clemastina têm mostrado potencial para estimular a remielinização em modelos pré-clínicos.
- Terapias Gênicas: editar genes específicos para corrigir defeitos que possam estar relacionados à EM, assim como moléculas de RNA estão sendo estudadas para silenciar genes envolvidos na resposta autoimune.
- Terapias com Células-Tronco: Transplante de células-tronco hematopoiéticas (HSCT), como uma forma de “redefinir” o sistema imunológico, embora não signifique a cura completa.
- Biomarcadores: identificação de biomarcadores que possam prever a progressão da doença e a resposta ao tratamento, permitindo abordagens mais personalizadas.
- Medicina Personalizada: personalização dos tratamentos com base nas características genéticas e moleculares do paciente está se tornando uma área de grande interesse, permitindo tratamentos mais eficazes e com menos efeitos colaterais.
- Tecnologias de Monitoramento e Diagnóstico: Ferramentas de IA estão sendo desenvolvidas para ajudar no diagnóstico precoce e no monitoramento da progressão da EM através da análise de imagens de ressonância magnética e outros dados clínicos. Tecnologias vestíveis e aplicativos também estão sendo usados para monitorar sintomas em tempo real, ajudando os médicos a ajustar tratamentos de forma mais dinâmica.
As estratégias de remielinização e neuroproteção no tratamento da esclerose múltipla (EM):
-Estimulação de Células Progenitoras Oligodendrocíticas (OPCs)
Durante o desenvolvimento embrionário, as OPCs são responsáveis pela produção de oligodendrócitos, as células que formam a mielina no sistema nervoso central (SNC). Em adultos, essas células progenitoras ainda estão presentes, mas sua capacidade de diferenciação em oligodendrócitos e de reparo é reduzida em doenças como a EM. Estão sendo desenvolvidas terapias que estimulam a proliferação e diferenciação das OPCs remanescentes
– Modulação da Microglia e do Ambiente Inflamatório
Em condições normais, a microglia auxilia na remoção de detritos celulares e na promoção de reparo, mas em estados crônicos de inflamação, como na EM, ela pode contribuir para danos adicionais.Intervenções que modulam a atividade da microglia para promover um ambiente anti-inflamatório e neuroprotetor estão sendo investigadas.
– Inibição de Sinais Inibitórios
Durante o desenvolvimento embrionário, certos sinais moleculares inibem a remielinização para garantir a formação adequada de circuitos neuronais. Em adultos com EM, esses sinais podem ser reativados, bloqueando o reparo.
– Terapias Gênicas e Modificação Epigenética
– Uso de Compostos Remielinizantes
– Neuroproteção Através de Modulação Mitocondrial
– Estimulação de Caminhos de Sinalização
Referências
- DeSilva, T. M. Remyelinating versus neuroprotective therapies for multiple sclerosis. 2023. Disponível em: https://www.openaccessgovernment.org/article/remyelinating-versus-neuroprotective-therapies-for-multiple-sclerosis-ms-cleavland-clinic/149585/. Acesso em: 12 ago. 2024
- EDUARDA, M. et al. Terapias Emergentes na Esclerose Múltipla: Perspectivas e Futuro. Brazilian Journal of Implantology and Health Sciences, v. 5, n. 5, p. 4828–4841, 7 dez. 2023.
- HANDLEY, E. Regenerative therapies for multiple sclerosis: Clues from studying normal brain development. Disponível em: https://www.openaccessgovernment.org/regenerative-therapies-for-multiple-sclerosis-clues-from-studying-normal-brain-development/138080/.
- JUNQUEIRA, L.C.; CARNEIRO, J. Tecido nervoso. In: JUNQUEIRA, L.C.; CARNEIRO, J. Histologia básica. 12. ed. Rio de Janeiro: Guanabara Koogan, 2013. p. 151-175
- LANCELLOTTI, C. L. P. et al. Esclerose múltipla: estudo clínico e patológico de um caso. Arquivos de Neuro-Psiquiatria, v. 47, n. 4, p. 455–460, dez. 1989.
- MAZUR, E. K.; GABRIEL, M. F. C. REVISÃO COMPARATIVA DA HISTOLOGIA DO TECIDO NEURAL NA ESCLEROSE MÚLTIPLA. In: Anais do Congresso Nacional de Neurologia Multidisciplinar. Anais. Sete Lagoas(MG) Online, 2024. Disponível em: https//www.even3.com.br/anais/1-congresso-nacional-de-neurologia-multidisciplinar-412958/807801-REVISAO-COMPARATIVA-DA-HISTOLOGIA-DO-TECIDO-NEURAL-NA-ESCLEROSE-MULTIPLA. Acesso em: 11 ago. 2024

