TEMA: TERATOGÊNESE E SUPLEMENTAÇÃO NA GESTAÇÃO
Quando a ficção científica encontra a biologia do desenvolvimento, o resultado pode ser tão perturbador quanto fascinante. The Boys: Gen V, derivada do universo brutal e satírico de The Boys, mergulha nas consequências de expor corpos em formação a substâncias capazes de alterar completamente seu destino — um paralelo direto com o conceito real de teratogênese. Enquanto a série mostra jovens “supers” moldados desde o nascimento pelo Composto V, a ciência explica como agentes externos podem interferir no desenvolvimento embrionário e fetal, causando malformações ou mudanças profundas na formação do organismo.
1. Teratogênese e períodos críticos de desenvolvimento.
A teratogênese corresponde às alterações no desenvolvimento embriofetal provocadas por agentes externos capazes de interferir em processos morfológicos e funcionais. A compreensão desses efeitos depende do reconhecimento de que o desenvolvimento humano ocorre em etapas organizadas, nas quais cada estrutura apresenta vulnerabilidades específicas. O período embrionário e o período fetal não constituem fases homogêneas, mas sim momentos distintos de formação, diferenciação e maturação.
A formação do palato secundário é um exemplo de processo altamente sensível. Bush e Jiang (2012), ao descreverem a morfogênese palatina, afirmam que “a palatogênese é um processo de desenvolvimento altamente regulado”. Esse processo envolve crescimento, elevação e fusão de prateleiras palatinas, etapas que dependem de mecanismos celulares sequenciais. Qualquer interferência nesse intervalo pode impedir a fusão adequada, levando à formação de uma fenda palatina. Como cada etapa ocorre em um momento preciso, o risco de malformação está diretamente relacionado ao tempo de exposição.
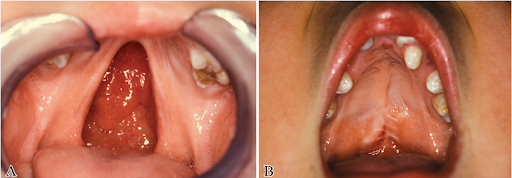
Fonte: https://www.scielo.br/j/rbcp/a/wZ8cjQY9Tk3cHtb3ZvqwmhQ/?lang=pt
O fechamento do tubo neural constitui outro exemplo marcante de um período crítico. Copp, Stanier e Greene (2013) explicam que “a neurulação é um processo dinâmico e composto por múltiplas etapas”, caracterizado por eventos sucessivos de dobra, elevação e fusão do neuroepitélio. Alterações que atinjam esse processo durante a fase correspondente resultam em anencefalia, espinha bífida ou outros defeitos do tubo neural. O caráter de múltiplas etapas descrito pelos autores evidencia que cada estágio possui vulnerabilidade temporal própria, o que fundamenta o conceito de janela crítica para essa estrutura.
No período fetal, embora grande parte da organogênese esteja concluída, alguns sistemas permanecem em maturação intensa, especialmente o sistema nervoso central. Riley et al. (2011) destacam que “os efeitos mais profundos e duradouros da exposição pré-natal ao álcool ocorrem sobre o cérebro em desenvolvimento”. O cérebro atravessa fases prolongadas de sinaptogênese, migração neuronal e mielinização, o que explica por que exposições tardias podem gerar déficits cognitivos e comportamentais mesmo na ausência de malformações anatômicas visíveis. A Síndrome Alcoólica Fetal (SAF) exemplifica bem esse padrão, pois resulta da exposição pré-natal ao álcool e afeta as funções cognitivas e comportamentais, pois o cérebro permanece vulnerável ao longo do período fetal. Esses três exemplos permitem compreender como o desenvolvimento humano é estruturado em fases críticas. Durante o período embrionário, interferências tendem a gerar malformações estruturais porque os órgãos estão sendo formados. Já no período fetal, predominam prejuízos funcionais, sobretudo neurológicos, pois os tecidos passam por refinamento e maturação.
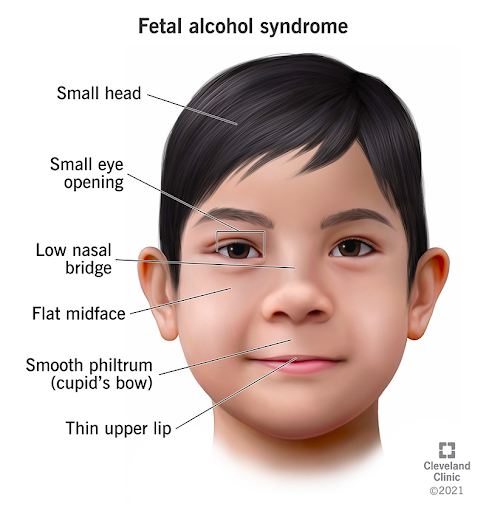
Fonte: https://my.clevelandclinic.org/health/diseases/15677-fetal-alcohol-syndrome
Esses três exemplos permitem compreender como o desenvolvimento humano é estruturado em fases críticas. Durante o período embrionário, interferências tendem a gerar malformações estruturais porque os órgãos estão sendo formados. Já no período fetal, predominam prejuízos funcionais, sobretudo neurológicos, pois os tecidos passam por refinamento e maturação. Dentro desse contexto, a janela crítica corresponde ao intervalo específico em que um tecido ou órgão está em formação ativa e, portanto, mais vulnerável à ação de agentes externos. Quando a exposição ocorre exatamente nesse período, o risco de alterações no desenvolvimento aumenta consideravelmente, enquanto exposições fora desse intervalo podem não produzir efeitos importantes. Essa lógica temporal ajuda a explicar por que diferentes estruturas respondem de maneira distinta ao mesmo agente ao longo da gestação.
Essa lógica biológica ajuda a entender por que narrativas ficcionais como The Boys e Gen V costumam vincular os efeitos do Composto V ao momento da exposição. Embora os resultados apresentados sejam biologicamente impossíveis, a estrutura narrativa segue o princípio real de que diferentes fases do desenvolvimento respondem de forma distinta a um agente externo. Exposições precoces resultam, na ficção, em alterações estruturais amplas, enquanto exposições tardias produzem mudanças funcionais e comportamentais. A ficção exagera os resultados, mas preserva a lógica temporal observada em fenômenos embriológicos reais.
2. Teratógenos reais: medicamentos, químicos e álcool.
Os teratógenos constituem um grupo heterogêneo de agentes capazes de provocar alterações estruturais, funcionais ou neurocomportamentais no embrião ou no feto. A susceptibilidade aos danos varia de acordo com o período gestacional, sendo a fase da organogênese, especialmente entre a 3ª e a 8ª semana, o intervalo de maior vulnerabilidade. Entre os principais teratógenos estudados, destacam-se o álcool, a talidomida, os retinoides e o ácido valpróico, os quais apresentam mecanismos distintos, mas todos convergem para o comprometimento do desenvolvimento embriofetal.
A exposição pré-natal ao álcool é amplamente documentada como causadora de prejuízos persistentes. O álcool exerce efeitos tóxicos e teratogênicos que se estendem desde a vida fetal até a adolescência e a vida adulta, resultando em distúrbios neurocomportamentais, déficits cognitivos, alterações faciais características e prejuízo no crescimento. Os autores explicam que esses efeitos resultam de mecanismos como estresse oxidativo, morte celular aumentada e interferência na migração neuronal, culminando na Síndrome Alcoólica Fetal, uma das principais causas evitáveis de atraso no neurodesenvolvimento.
Outro teratógeno historicamente marcante é a talidomida, o fármaco foi inicialmente comercializado como sedativo e antiemético, sendo posteriormente retirado do mercado após causar milhares de casos de focomelia e malformações graves. Embora tenha retornado ao uso clínico em condições específicas, como hanseníase e mieloma, sua teratogenicidade permanece inquestionável, estando associada principalmente à inibição da angiogênese embrionária e à interferência em vias de desenvolvimento de membros. Os autores ressaltam que, apesar de sua “renascença terapêutica”, as preocupações de segurança continuam centrais.
Os retinoides, particularmente a isotretinoína, constituem outro grupo de forte impacto teratogênico. Esses compostos, derivados da vitamina A, alteram a regulação da expressão gênica durante o desenvolvimento, afetando diretamente processos de diferenciação celular, formação do sistema nervoso central e desenvolvimento craniofacial. A exposição durante a gestação pode resultar em microtia, malformações cardíacas, anomalias do timo e prejuízos neurológicos, razão pela qual esses fármacos são rigidamente contraindicados para gestantes.
O ácido valpróico, por sua vez, é extensamente utilizado no tratamento de epilepsia e transtornos psiquiátricos, mas apresenta reconhecida capacidade teratogênica. A exposição fetal ao valproato está associada a defeitos do tubo neural, alterações craniofaciais, prejuízos cognitivos e risco aumentado de transtornos do neurodesenvolvimento. Em nível molecular, o fármaco atua como inibidor de histona desacetilase (HDAC), modificando a regulação epigenética e impactando vias essenciais para a proliferação e diferenciação celular. Essas alterações ajudam a explicar tanto as malformações estruturais quanto os efeitos comportamentais observados em humanos e modelos animais.
Assim, os dados provenientes reforçam a importância do reconhecimento e da prevenção da exposição a agentes teratogênicos durante a gestação. Cada um dos teratógenos descritos: álcool, talidomida, retinoides e ácido valpróico; apresenta mecanismos específicos, mas todos interferem em processos fundamentais do desenvolvimento embrionário, demonstrando que a integridade do ambiente intrauterino é essencial para o crescimento saudável do futuro indivíduo.
3. Suplementação adequada na gestação.
A suplementação gestacional é considerada indispensável porque fornece nutrientes que sustentam etapas fundamentais da embriogênese, como divisão celular, formação de tecidos e desenvolvimento neurológico, prevenindo falhas nessas fases críticas. O ácido fólico garante a síntese de DNA e o fechamento do tubo neural, prevenindo anencefalia e espinha bífida; o ferro assegura a produção de hemoglobina e evita anemia materna, hipóxia fetal e restrição de crescimento; o iodo é essencial aos hormônios tireoidianos e ao desenvolvimento cerebral, prevenindo déficit cognitivo e cretinismo; vitamina D e cálcio favorecem a mineralização óssea e reduzem riscos como osteopenia e pré-eclâmpsia; enquanto vitamina B12 e ômega-3 apoiam a formação sanguínea e a maturação neurológica, evitando neuropatias e anemia megaloblástica. Ao contrário do Composto V de The Boys, que altera geneticamente seus usuários, os suplementos não modificam o DNA do feto, apenas garantem que seu desenvolvimento natural ocorra de forma saudável.
4. Microscopia e biologia celular: como as substâncias alteram a diferenciação.
A diferenciação celular pode ser definida como o conjunto de eventos que leva à aquisição do padrão de expressão gênica encontrado em cada tipo celular e a sua manutenção. É um processo que começa a ocorrer no embrião de forma definitiva a partir da gastrulação, quando há a formação dos três folhetos embrionários, o endoderma, o mesoderma e o ectoderma. Nesse estágio, há intensa migração celular, onde ocorrem também complexas interações teciduais. Com o decorrer do desenvolvimento, as células se diferenciam e se agrupem de modo que sejam organizados os diferentes tecidos e órgãos, processo conhecido como organogênese. A característica celular é modulada pelo conjunto de proteínas reguladoras presentes na célula. As proteínas controlam a expressão gênica da célula, que faz com que ela se especifique. Os componentes determinantes são expressos pelo genoma em resposta a um fator, e atuam sobre a expressão celular para mantê-la seletiva aos genes específicos ativados pela determinação. Esses fatores fazem com que exista um tipo de memória celular sobre o fenótipo determinado. Em The Boys, bebês expostos ao Composto V não seguem a diferenciação celular normal, suas células são reprogramadas para dar origem a tecidos com propriedades diferentes.
Citotoxicidade: um composto é considerado citotóxico quando danifica a subestrutura ou a função de uma célula, frequentemente levando à morte celular.
Há proteínas reguladoras que controlam a proliferação celular. As quinases dependentes de ciclina (CDKS), em associação com subunidades reguladoras de ciclina, são os principais reguladores do ciclo de divisão celular. Dependendo da atividade dos complexos CDK-ciclina na fase G1, as células podem interromper a divisão celular ou se comprometer a passar por um ciclo de divisão. Essa decisão depende de sinais extracelulares e informações intrínsecas da célula, que determinam a reativação da CDK após o ciclo celular anterior. O descontrole na proliferação celular leva ao crescimento de tumores. Há tumores benignos, que apresentam características que lembram as células ou os tecidos dos quais se originaram, e apresentam um crescimento relativamente lento e não invadem os tecidos vizinhos. Os tumores malignos lembram vagamente os tecidos normais dos quais se originaram, com um arranjo estrutural desordenado, além de acentuadas alterações celulares. Células malignas possuem elevada capacidade de proliferação e invasão dos tecidos circunvizinhos. Uma mutação em um gene que modula a proliferação pode resultar em transformação do fenótipo celular. Esses genes são classificados como oncogenes, ou seja, genes causadores do câncer. As células já diferenciadas podem passar a se comportar como uma célula indiferenciada.
Uma mutação genética é uma alteração na sequência do seu DNA, causada pela remoção, adição ou substituição de partes do seu DNA. As mutações genéticas ocorrem durante a divisão celular, quando as células se dividem e se replicam. Se houver um erro durante a síntese de DNA, como conter partes faltantes ou desnecessárias na sequência de DNA, pode fazer com que as células não consigam funcionar normalmente. A mutação genética altera a informação que as células precisam para se formar e funcionar. Os genes são responsáveis pela produção de proteínas que informam ao corpo quais características físicas devemos ter. Se tiver uma mutação genética, pode ocorrer de apresentar sintomas de uma doença genética, pois as células estarão desempenhando uma função diferente da que deveriam. Uma doença genética é uma condição causada por alterações no genoma. Isso inclui o DNA, os genes e os cromossomos. Alguns fatores causam doenças genéticas como:
- Mutação de um gene (monogênica)
- Mutação de múltiplos genes (herança multifatorial)
- Mutação de um ou mais cromossomos
- Fatores ambientais (exposição a produtos químicos, raios UV) que alteram sua composição genética
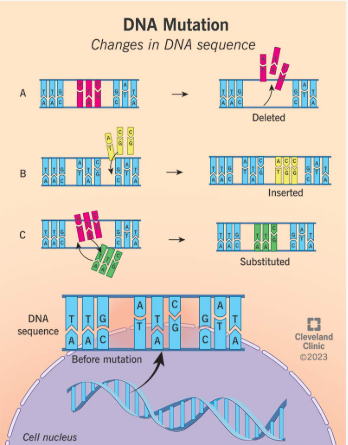
Fonte: Cleveland Clinic https://my.clevelandclinic.org/health/body/23095-genetic-mutations-in-humans
REFERÊNCIAS:
- BUSH, J. O.; JIANG, R. Palatogenesis: morphogenetic and molecular mechanisms of secondary palate development. Development, v. 139, n. 2, p. 231–243, 2012. Disponível em: https://pmc.ncbi.nlm.nih.gov/articles/PMC3243091/. Acesso em: 20 nov. 2025.
- CARVALHO, H. F.; RECCO-PIMENTEL, S. M. A célula. 3. ed. Barueri, SP: Manole, 2013. ISBN 978-85-204-3578-6.
- CHUNG, D. D. et al. Toxic and teratogenic effects of prenatal alcohol exposure on fetal development, adolescence, and adulthood. International Journal of Molecular Sciences, v. 22, n. 16, p. 1–25, 2021. DOI: 10.3390/ijms22168785.
- CLEVELAND CLINIC. Genetic mutations in humans. Cleveland Clinic, [s.d.]. Disponível em: https://my.clevelandclinic.org/health/body/23095-genetic-mutations-in-humans. Acesso em: 19 nov. 2025.
- COPP, A. J.; STANIER, P.; GREENE, N. D. E. Neural tube defects: recent advances, unsolved questions, and controversies. Journal of Anatomy, v. 222, p. 1–15, 2013. Disponível em: https://pmc.ncbi.nlm.nih.gov/articles/PMC4023229/. Acesso em: 20 nov. 2025.
- MOORE, K. L.; PERSAUD, T. V. N.; TORCHIA, M. G. Embriologia clínica. 10. ed. Rio de Janeiro: Elsevier, 2016.
- ORNOY, A.; ECHEFU, B.; BECKER, M. Valproic acid in pregnancy revisited: neurobehavioral, biochemical and molecular changes affecting the embryo and fetus in humans and in animals: a narrative review. International Journal of Molecular Sciences, v. 25, n. 1, p. 1–23, 2023. DOI: 10.3390/ijms25010390.
- RILEY, E. P.; INFANTE, M. A.; WARREN, K. R. Fetal alcohol spectrum disorders: an overview. Neuropsychology Review, v. 21, n. 2, p. 73–80, 2011. Disponível em: https://pmc.ncbi.nlm.nih.gov/articles/PMC3779274/. Acesso em: 20 nov. 2025.
- RUIJTENBERG, S.; VAN DEN HEUVEL, S. Coordinating cell proliferation and differentiation: antagonism between cell cycle regulators and cell type-specific gene expression. Cell Cycle, v. 15, n. 2, p. 196–212, 2016. Disponível em: https://pmc.ncbi.nlm.nih.gov/articles/PMC4825819/. Acesso em: 19 nov. 2025.
- SOPRANO, D. R.; SOPRANO, K. J. Retinoids as teratogens. Annual Review of Nutrition, v. 15, p. 111–132, 1995. DOI: 10.1146/annurev.nu.15.070195.000551.
- VARGESSON, N.; STEPHENS, T. Thalidomide: history, withdrawal, renaissance, and safety concerns. Expert Opinion on Drug Safety, v. 20, n. 12, p. 1455–1457, 2021. DOI: 10.1080/14740338.2021.1991307.

