LAEMA POP: The Last Of Us
TEMA : FUNGOS PARASITAS
1 – CANDIDA AURIS
A C. auris é um patógeno emergente associado a múltiplas infecções nosocomiais em cinco continentes. A análise genômica indica que grupos ancestrais separados desse microrganismo surgiram simultaneamente em diferentes regiões geográficas. A resistência desse microrganismo aos fármacos antifúngicos e a dificuldade na identificação da espécie com os diagnósticos laboratoriais tradicionais aumentaram as preocupações. O aumento da colonização e da infecção por espécies de Candida não albicans é atribuído, em parte, ao maior uso de agentes antifúngicos profiláticos. Existe uma associação de C. auris com unidades de terapia intensiva e uso de cateteres venosos centrais ou urinários, de modo que a formação de biofilmes constitui um mecanismo de virulência sugerido desse microrganismo. Foi relatada uma resistência variável a fármacos, porém diversos estudos demonstraram uma resistência aos antifúngicos triazóis e uma suscetibilidade variável à anfotericina B. Foi relatada a colonização das narinas, da virilha, das axilas e do reto com C. auris. A mortalidade em pacientes com infecção invasiva por C. auris varia, porém com algumas taxas elevadas relatadas de até 50%; tem sido difícil determinar a mortalidade atribuível em uma população de pacientes vulneráveis com comorbidades complexas. Foi constatado que C. auris sobrevive em superfícies secas e úmidas por até 14 dias, de modo que a limpeza ambiental para eliminar uma fonte de infecções nosocomiais representa um desafio.
Quando se fala da morfologia a nível microscópico, as células da C. auris são ovais e ausente de pseudo-hifas. Entretanto, C. auris pode apresentar propriedades diferentes na presença de concentrações elevadas de cloreto de sódio que, por sua vez, induzem a criação de pseudo-hifas. Em relação às características microbiológicas, é possível encontrar uma diversidade conforme a escolha do meio de cultura. No meio ágar Sabouraud, a C. auris desenvolve colônias lisas com coloração que varia de branca a creme. Já no meio CHROMagar Candida, a C. auris produz colônias rosa claro ou rosa escuro, podendo ser capaz de crescer a 42ºC, que a difere das demais espécies. A C. auris pode apresentar uma forma peculiar de crescimento in vitro, podendo não liberar suas células filhas após a brotação, resultando em uma grande agregação de células com alta resistência física, o que poderia lhes conferir alguma resistência nos tecidos e no ambiente. Em um modelo invertebrado de Galleria mellonella, a forma não agregada apresentou maior patogenicidade, semelhante a C. albicans. Além disso, a forma não agregada é capaz de formar biofilmes mais fortes com maior patogenicidade e maiores taxas de mortalidade em comparação com a versão agregada. Devido a essa capacidade de formar biofilmes variantes, a C. auris é considerado um patógeno de difícil erradicação
2 – MUCORALES (FUNGO NEGRO)
A mucormicose é uma infecção fúngica oportunista, altamente invasiva, não transmissível, causada por fungos da ordem Mucorales, dos gêneros Rhizopus spp., Rhizomucor spp. ou Mucor spp., Lichtheimia spp, Cunninghamella spp. Ela foi descrita pela primeira vez pelo patologista alemão Richard Paultauf, em 1885, a qual correspondia a uma infecção sistêmica com envolvimento gástrico e rinocerebral.
Esses fungos podem ser encontrados em resíduos orgânicos em decomposição, pão, frutas, matéria vegetal, alimentos contaminados, fezes de animais e podem infectar o homem por inalação, inoculação ou até mesmo ingestão dos esporos dispersos no ambiente.
Essa doença se apresenta principalmente nas formas rino-órbito-cerebral (nariz, olhos e cabeça), pulmonar, gastrointestinal, cutânea e outras formas. É uma doença extremamente grave e de rápida evolução para óbito, em razão do acelerado crescimento do fungo e destruição de tecido. Por isso, deve ser diagnosticada e tratada precocemente, podendo afetar quase qualquer parte do corpo, com infecções rinocerebrais e pulmonares causadas pela inalação de esporos e infecções cutâneas causadas por esporos que entram na pele. A mucormicose gastrointestinal pode ocorrer quando alimentos ou produtos contaminados são introduzidos no trato gastrointestinal.
Os mucormicetos podem se infiltrar nos vasos sanguíneos e se espalhar para o cérebro e outros órgãos através da corrente sanguínea,resultando em infecções disseminadas. Os fatores de risco para mucormicose incluem imunossupressão, com muitas infecções observadas em pessoas que tiveram células-tronco ou transplante de órgão sólido, neoplasias hematológicas e tratamento de longo prazo com corticosteroides.
Os principais sinais e sintomas são lesões necróticas invasivas no nariz e no palato acompanhadas de dor e febre. Infecção nos olhos, deslocamento do globo ocular e secreção nasal com pus também podem ser indicativos da doença.Podem ocorrer sintomas pulmonares graves que incluem tosse com secreção, febre alta, falta de ar ou dificuldade para respirar, além de infecção disseminada em pessoas que tenham comprometimento grave do sistema imunológico.
A confirmação laboratorial de mucormicetos em amostras de pacientes é uma parte central de todas as definições de caso, embora a capacidade laboratorial de micologia varie de hospital para hospital. Aqueles com experiência em micologia devem identificar as espécies de culturas suspeitas de mucormicetos, embora a identificação das espécies de mucormicetos possa ser difícil e erros de identificação ocorram comumente em laboratórios clínicos. Onde a capacidade é limitada, as culturas podem ser enviadas para laboratórios de diagnóstico de referência. O teste de reação em cadeia da polimerase (PCR) pode identificar mucormicetos em alguns espécimes de biópsia fixados em formalina e embebidos em parafina com evidência histopatológica de hifas fúngicas no CDC. No entanto, esta técnica é fortemente dependente da fonte, abundância e qualidade do espécime. Algumas análises sugeriram que o teste de PCR para detectar DNA de mucormiceto no soro pode ser útil na triagem de pacientes em risco, com detecção mais rápida e resultados que são concordantes com cultura ou espécies de mucormiceto identificadas por PCR de tecido. Identificar a presença de um mucormiceto por imuno-histoquímica pode ser útil durante a investigação inicial, mesmo na ausência de um gênero ou espécie definitiva.
Imagem 1 – Mucorales
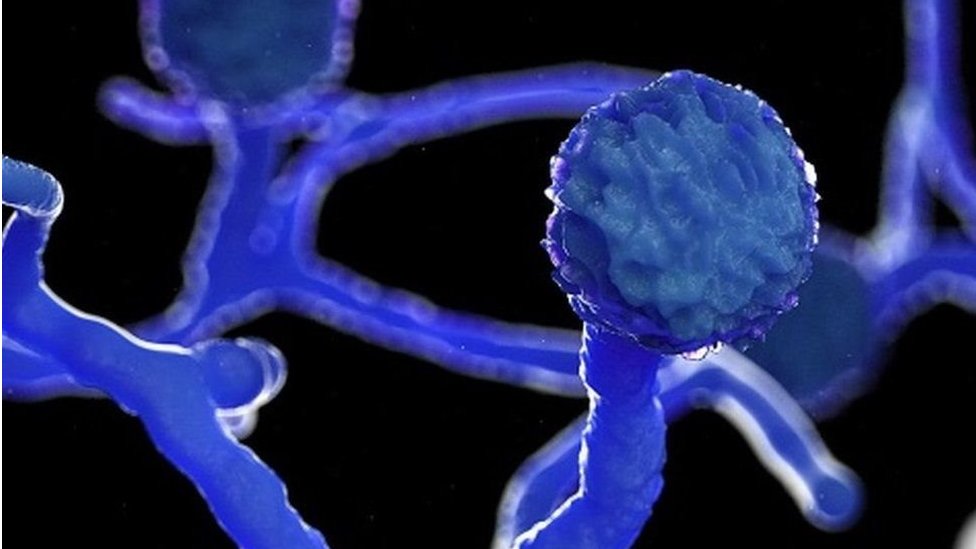
Fonte: BBC News Brasil(2021)
Imagem 2 – Colônia de fungos Mucor (Mucorales), causa mucormicose (ou doença do fungo preto)
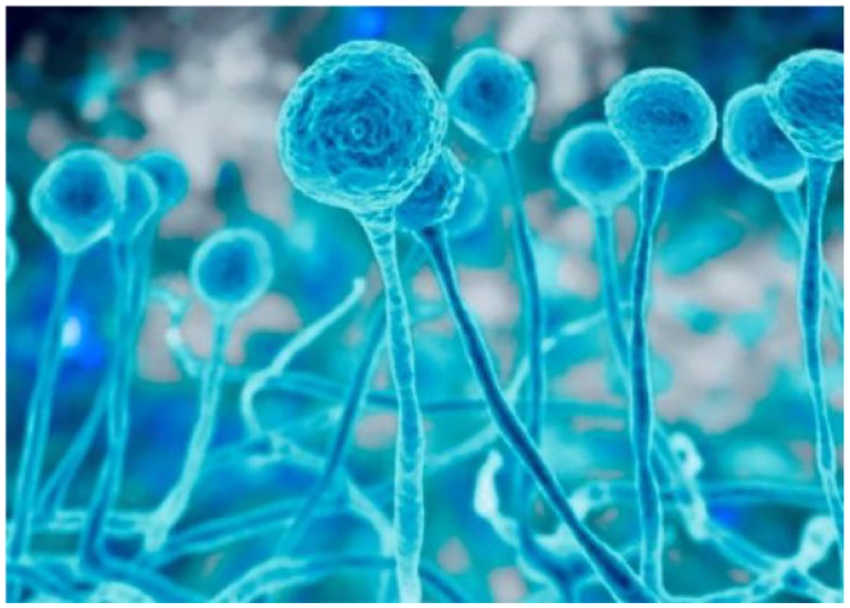
Fonte: Research Gate(2022)
3 – CRYPTOCOCCUS GATTII
A criptococose, ou torulose, é uma infecção fúngica sistêmica de distribuição mundial e caráter oportunista, causada por fungos do gênero Cryptococcus. Esse fungo, integrante da classe Blastomycetes e da família Cryptococcaceae, inclui duas importantes espécies para o estudo da patologia humana e animal: C. neoformans var. neoformans e C.neoformans var. gattii.
Conhecida desde 1905, essa doença foi descrita pela primeira vez pelo patologista alemão David Paul von Hansemann como uma afecção do sistema nervoso central (neurocriptococose), na qual o C. neoformans provoca meningoencefalite em indivíduos saudáveis, ocasionando também (e com mais frequência) infecção oportunista em pacientes com AIDS, leucemia, linfoma, lúpus eritematoso sistêmico ou sarcoidose, bem como em receptores de transplante imunossuprimidos. Essa espécie fúngica, amplamente distribuída, é encontrada no solo e no excremento de aves (principalmente pombos), infectando o indivíduo pela inalação das formas leveduriformes.
Já o C. gattii caracteriza-se por ser um agente infeccioso mais obscuro, com uma distribuição mais limitada que seu parente próximo, geralmente encontrado em zonas rurais. Com base nos achados em áreas onde essa espécie é monitorada, parece que ele tem uma maior tendência que o C. neoformans a causar doença em indivíduos imunologicamente normais, provocando extensas lesões que produzem efeitos expansivos ou que simulam o aspecto radiológico de uma neoplasia. O Cryptococcus gattii está associado a certas espécies de árvores e é também encontrado no solo, podendo estabelecer infecção tanto por meio da via respiratória, pela sua inalação, mas também por meio da via gastrointestinal, pela sua ingestão, ou por meio da via cutânea, pela sua inoculação através de objetos perfurocortantes contaminados ou lesões epiteliais já existentes.
Imagem 3 – Isolamento de solo de Cryptococcus.
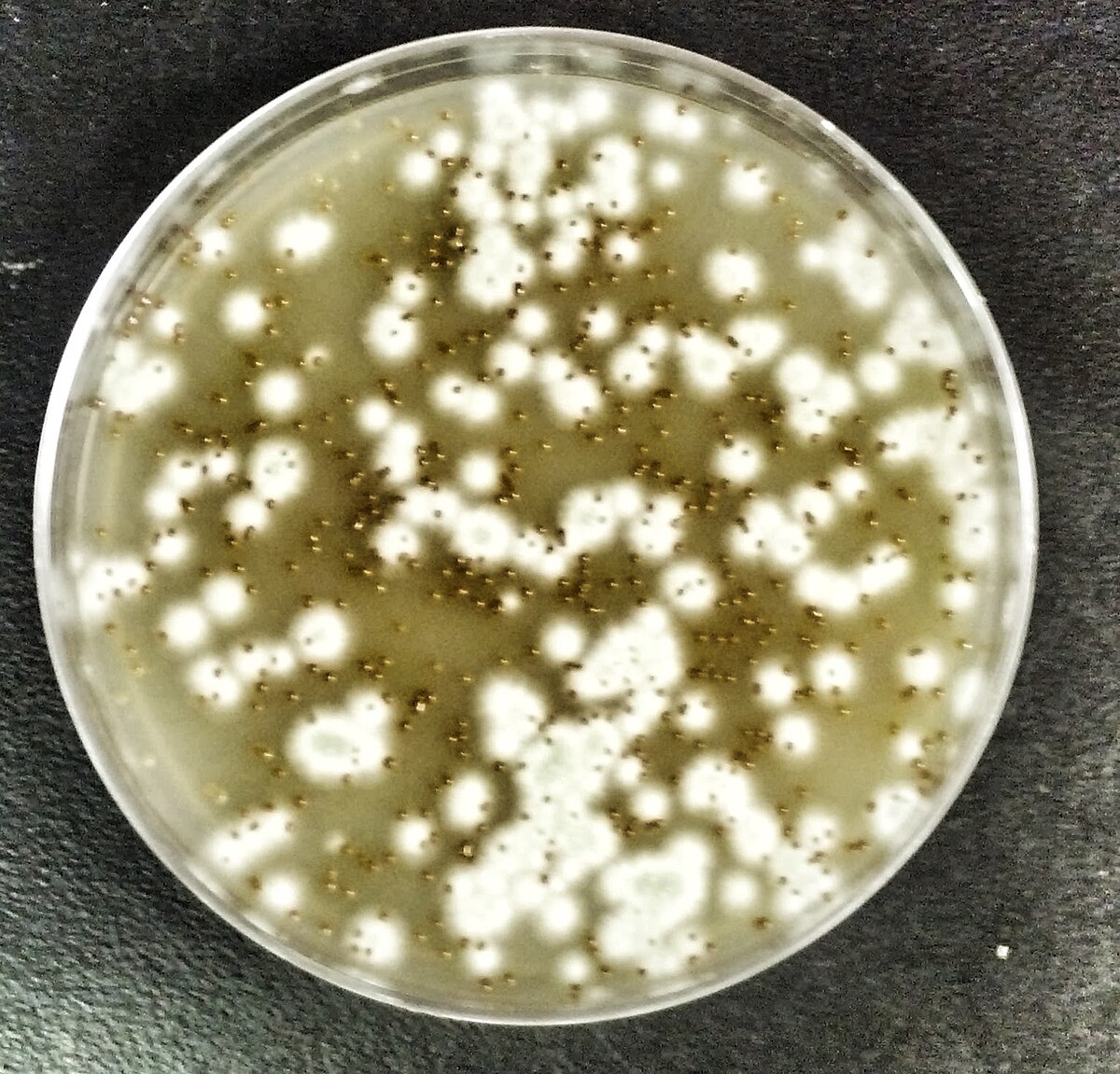
Fonte: Wikipedia Commons(2014)
As principais lesões causadas por Cryptococcus spp. estão localizadas no SNC e acometem as meninges, a substância cinzenta cortical e os núcleos da base. Em indivíduos imunossuprimidos, os microrganismos podem praticamente não induzir nenhuma reação inflamatória, de modo que as massas gelatinosas de fungos crescem nas meninges ou expandem os espaços perivasculares na substância cinzenta, produzindo lesões em forma de bolhas de sabão. Caracteriza-se por sintomas como cefaleia, febre, vômitos, alterações visuais e outros sinais de irritação meníngea, com duração que pode variar de dias a semanas.
Outra manifestação clínica da infecção é a pulmonar, a criptococose pulmonar pode apresentar-se de forma assintomática ou evoluir para a síndrome do desconforto respiratório agudo (SDRA). Quando há sintomas, os mais frequentes são febre, tosse, produção de expectoração, dor pleurítica, dificuldade em respirar, perda de peso e, em casos raros, hemoptises.
4 – REFERÊNCIAS
- BRASIL. Ministério da Saúde. Mucormicose (Fungo Negro). [Data de publicação não especificada]. Disponível em: https://www.gov.br/saude/pt-br/assuntos/saude-de-a-a-z/m/mucormicose. Acesso em: 22 abr. 2025.
- GETTY IMAGES. Disponível em: https://stackoverflow.com/questions/4532782/do-extension-in-web-pages. Acesso em: 22 abr. 2025.
- HARTNETT, Kathleen P. et al. Fungo Negro. 18 maio 2021.
- IQTADAR, Somia; HASHMAT, Masooma; AKBAR, Nabeel; KHAN, Amjad. Colony of the Mucor fungi (Mucorales), also known as black fungus, causes mucormycosis (or black fungus disease). ResearchGate, 2021.
- KUMAR, Vinay; ABBAS, Abul K.; ASTER, Jon C. Robbins & Cotran Patologia: Bases Patológicas das Doenças. 10. ed. Rio de Janeiro: GEN Guanabara Koogan, 2023. E-book. p. 349. ISBN 9788595159174. Disponível em: https://app.minhabiblioteca.com.br/reader/books/9788595159174/. Acesso em: 21 abr. 2025.
- MIRANDA, Alice Vasconcelos et al. Mortalidade por criptococose no Brasil entre 2020 e 2023. Journal of Health & Biological Sciences, v. 12, n. 1, p. 1-4, 2024.
- REIS-FILHO, João Baptista dos et al. O líquido cefalorraquiano inicial nas meningencefalites por Cryptococcus neoformans. Revista do Instituto de Medicina Tropical de São Paulo, v. 27, p. 173-178, 1985.
- SCHAEFER, Crislane Costa et al. Cândida auris: características clínicas de uma levedura nosocomial emergente resistente a medicamentos. Brazilian Journal of Development, Curitiba, v. 8, n. 5, p. 37062–37077, maio 2022. DOI: 10.34117/bjdv8n5-287. Acesso em: 21 abr. 2025.
- UNIVERSIDADE ESTADUAL DE CAMPINAS. Núcleo de Pesquisa em Tecnologia da Criptografia (NPTCripto). Disponível em: https://anatpat.unicamp.br/nptcripto2.html. Acesso em: 27 abr. 2025.
- WIKIMEDIA COMMONS. File: Cryptococcus gattii selection.jpg. Disponível em: https://commons.wikimedia.org/w/index.php?title=File:Cryptococcus_gattii_selection.jpg&oldid=871614148. Acesso em: 27 abr. 2025.

