Revisa LAEMA: Técnicas de microscopia
Data da publicação: 10 de setembro de 2024 Categoria: Revisa LAEMA
1 – Microscopia Óptica Convencional
A microscopia óptica convencional é aquela cujo principal objeto utilizado para estudo de amostras é o microscópio óptico ou microscópio de luz. Esse aparelho é composto por uma porção mecânica, que dá estrutura, e uma porção óptica, que possui uma fonte emissora de luz e, normalmente, três lentes:
- Lente condensadora/Condensador: responsável por condensar a luz em um cone que atravessa a amostra e chega até a objetiva;
- Lente objetiva: projeta uma imagem aumentada, porém invertida da amostra para a lente ocular, elas podem funcionar sem ou com a adição de líquidos que mudam o índice de refração da luz e permitir um maior aumento da imagem obtida;
- Lente ocular: é responsável por ampliar ainda mais a imagem projetada pela lente objetiva e possibilita sua visualização de forma direita.
Em alguns microscópios há ainda uma estrutura entre a fonte de luz e o condensador chamada diafragma que regula o diâmetro do feixe de luz que entra na lente e pode ser controlado por quem está operando ajudando no contraste da imagem observada pela perda ou ganho de luz na amostra.
2 – Microscopia Eletrônica de Transmissão (TEM)
Por microscopia eletrônica de transmissão foi possível realizar a análise ultra estrutural da célula, observando a presença, localização e quantificação de organelas celulares relacionadas ao metabolismo deste tipo celular e especializações de membrana como cavéolas.
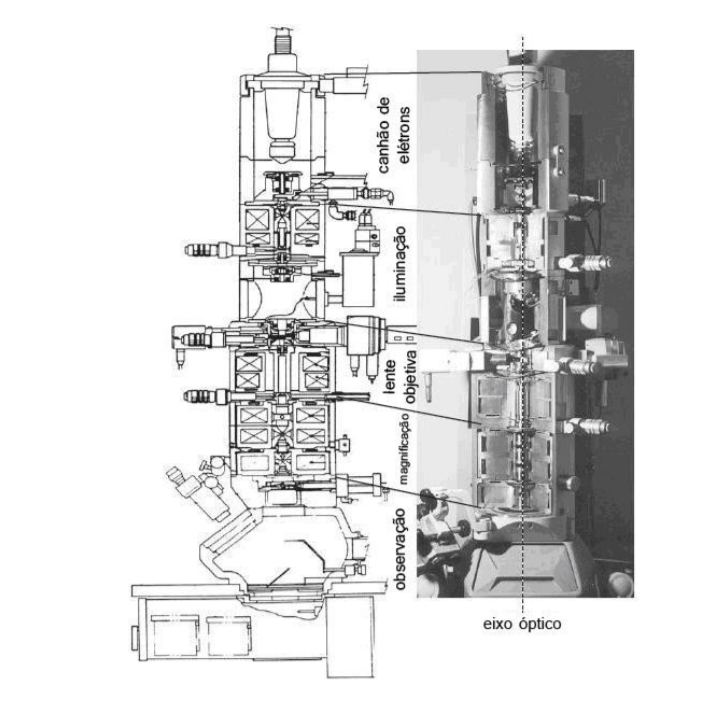
Fonte: desenho reproduzido e traduzido de De Graef, 2003, p.140
Ao fluir uma corrente através do filamento, ele é aquecido por incandescência, fazendo com que emita elétrons. Estes são atraídos em direção ao anodo, que tem carga oposta, e alguns deles passam através da abertura central. A proporção dos que assim fazem aumenta devido à presença da segunda placa metálica, denominada grade catódica ou Wehnelt, que é negativamente carregada em relação ao filamento. Esta carga negativa ocasiona a concentração dos elétrons, emitidos pelo filamento, em um feixe que passa simetricamente ao longo do eixo do canhão e através da abertura central do anodo(GRIMSTONE, 1980). Assim, os elétrons saem do filamento e são direcionados a um ponto chamado ponto de convergência (ou cross-over), entre o Wehnelt e o anodo. Essa conversão ocorre devido a um potencial (bias) aplicado no Wehnelt. O diâmetro do feixe é dado pelo tamanho do ponto de convergência (do) e o feixe é tão melhor em termos de coerência quanto menor for o do (WILLIANS, CARTER, 2009). Os principais mecanismos de contraste que geram diferenças nas imagens são o contraste da espessura em massa, contraste por difração (amplitude) e o contraste de fase.
- O contraste de espessura por massa se refere ao processo de espalhamento de elétrons pelos átomos da amostra que regulam a intensidade do feixe transmitido. Quanto maior a espessura da amostra ou quanto maior o número atômico, menor será o número de elétrons transmitidos, assim originando uma região mais escura na imagem gerada.
- O contraste de difração é referente ao espalhamento elástico em amostras cristalinas.
- O contraste de fase após os elétrons atravessarem a amostra, os feixes transmitidos e difratados podem ser recombinados no plano da imagem para resolução direta da rede cristalina, constituindo o contraste de fase (KESTENBACH, BOTTA FILHO, 1989).
A preparação de amostras para microscopia eletrônica de transmissão requer muito cuidado. O material precisa ser cortado em uma série de secções ultrafinas (GRIMSTONE, 1980). Para obtenção desses cortes, a amostra precisa ser submetida a vários processos específicos que garantam a preservação de suas propriedades originais durante a análise.
Esses passos variam de acordo com a amostra e objetivo de estudo, mas em linhas gerais, são:
- Fixação: Processo pelo qual se obtém estabilização das estruturas celulares e intracelulares. Idealmente a morfologia dos diferentes tipos de biomacromoléculas, suas relações topológicas, bem como da fase aquosa com os respectivos solutos devem ser preservados como na situação in vivo. Essa fixação pode ser feita por métodos físicos (como secagem ao ar e criofixação) ou fixação química (uso de fixadores goagulantes ou não aditivos e fixadores não coagulantes ou aditivos) e suas variações (SESSO, 1998).
- Desidratação: Esse passo é necessário devido ao fato de que todos os meios de inclusão (passo seguinte) usados em microscopia eletrônica não são miscíveis em água. Desse modo, torna-se necessário retirar toda a água do sistema biológico, o que deve ser feito de maneira gradual, pois modificações bruscas podem levar ao colabamento das projeções citoplasmáticas, afetando a estrutura celular. Após a fixação, o material deve ser bem lavado, iniciando-se o processo de desidratação por uma sequência de banhos de concentrações crescentes de um agente adequado que substitua a água e a elimine do espécime. Os desidratantes mais utilizados são o etanol e a acetona (MACHADO, SOUZA, 1998).
- Inclusão: A amostra deve ser incluída em um material, que é uma resina, que permita a posterior obtenção de cortes ultrafinos. Este material deve apresentar boa estabilidade quando submetido ao feixe de elétrons e possibilitar uma boa contrastação. Entre os exemplos de resinas, têm-se Epon, Spurr, Araldite. Antes de levar à estufa para polimerização, as amostras já infiltradas pela resina ainda fluida devem ser colocadas em blocos cilíndricos (cápsulas de gelatina) ou em moldes flexíveis com a devida identificação para o emblocamento . O tamanho dessa cápsula/molde deve corresponder ao suporte prendedor do ultramicrótomo (MACHADO, SOUZA, 1998).
- Ultramicrotomia: realização de cortes ultrafinos nas amostras emblocadas, com espessuras entre 10 e 100 nm. Os cortes devem ser realizados em micrótomos especiais providos de navalhas de fio mais uniforme e agudo do que as de aço, feitas de vidro, safira ou diamante. A extremidade do bloco deve ser lapidada em forma de pirâmide (Figura 4), à mão, com uma lima e uma lâmina ou em aparelhos especiais. Essa pirâmide deve ter o cume em forma de trapézio e com superfície mais plana possível. A navalha deve encontrar primeiro a base maior, para diminuir a compressão no momento do corte. Os cortes são colhidos sobre uma grade (grid – Figura 4) em geral de cobre, mas que também, quando necessário, pode ser de níquel ou de ouro. As grades podem ter 2,3 ou 3,5 nm de diâmetro e convém verificar qual o tamanho correspondente ao microscópio usado.(MACHADO, SOUZA, 1998; ATTIAS, 1998).
- Contrastação: As grades, já com os cortes, são colocadas sobre uma gota de acetato de uranila a 5% em água destilada durante 20-30 minutos, com o corte voltado para a gota. Depois deve ser lavada em água destilada, secada e colocada posteriormente sobre uma gota de citrato de chumbo durante 5 minutos. Esses processos são para intensificar o contraste dos cortes ultra finos (MACHADO, SOUZA, 1998).
Essa técnica permite analisar a amostra em seu interior, conforme os cortes ultrafinos realizados durante a preparação. A grande vantagem é o aumento com boa definição no qual o MET tem potencial para alcançar. No caso dessas imagens, chegou-se a um aumento de 50000x com uma escala nanométrica. Assim, podem-se observar várias estruturas subcelulares como núcleo, retículo endoplasmático, retículo endoplasmático rugoso, complexo de Golgi, gotas lipídicas, mitocôndrias e a membrana plasmática com especializações como as cavéola.
3 – Microscopia Eletrônica de Varredura (SEM)
É um tipo de microscopia em que um feixe de elétrons focalizado varre a superfície da amostra, interagindo com a matéria, gerando diferentes tipos de sinais que podem oferecer informações sobre a morfologia e composição química do material, as imagens geradas são de alta resolução que revelam detalhes em escalas nanométricas.
A técnica envolvida na SEM é especialmente eficaz para o estudo das superfícies das amostras, pois os elétrons interagem com os átomos da superfície, produzindo sinais que podem ser detectados e analisados para criar imagens detalhadas. Diferentes modos de operação do SEM permitem visualizar características como textura, composição, e topografia tridimensional. A profundidade de campo do SEM é muito maior que a da microscopia óptica tradicional, permitindo que grandes áreas da amostra estejam em foco simultaneamente, possibilitando um estudo mais eficaz da amostra.
Diversos tipos de amostras podem ser analisados em um microscópio eletrônico de varredura: metais, polímeros, materiais biológicos (dentes, ossos, insetos, plantas).
Em materiais biológicos, por exemplo, é possível visualizar a estrutura detalhada de células e tecidos. Já em materiais sólidos, a técnica pode revelar falhas superficiais, fraturas e outras características importantes para a caracterização de materiais. Algumas amostras biológicas requerem protocolos específicos no seu preparo de modo a serem desidratadas sem sofrerem alterações morfológicas.
Na ciência de materiais, o SEM é amplamente utilizado para a caracterização de metais, cerâmicas, polímeros e compósitos. A técnica é vital para entender as propriedades mecânicas e físicas dos materiais, fornecendo informações sobre a microestrutura e as interações entre diferentes fases dentro do material.
Em biologia, o SEM é utilizado para observar a morfologia de células, tecidos e organismos inteiros. Ele permite visualizar detalhes da superfície celular, como microvilosidades, desmossomos e outras estruturas subcelulares que são cruciais para entender funções biológicas e patologias. Além disso, pode ser combinado com técnicas de marcação e coloração para destacar componentes específicos das células, importante também para a compreensão das funções biológicas e patologias. Essa análise é crucial em estudos de doenças como o câncer, onde a morfologia celular pode mudar significativamente em comparação com células saudáveis.
Na nanobiotecnologia, o SEM é uma ferramenta essencial para a visualização e caracterização de nanopartículas, nanofios, nanotubos e outras nanoestruturas. A técnica é fundamental para o desenvolvimento de novos materiais e dispositivos em escala nanométrica, onde a precisão e o detalhamento das imagens fornecidas pelo SEM são indispensáveis.

Thermo Fisher Scientific Helios NanoLab 660
Microscópio eletrônico de duplo feixe que combina um microscópio eletrônico de varredura (SEM) com um microscópio de feixe de íons focalizado (FIB). Possui canhão de elétrons FEG Schottky com tensão de aceleração entre 20 V e 30 kV e canhão de íons de gálio com tensão de aceleração entre 500 V e 30 kV. Permite aquisição de imagens de elétrons secundários (SE), retroespalhados (BSE) e transmitidos (STEM), com resoluções de até 0.6 nm. Possui nanomanipulador, lente de imersão, monocromador, sistema de injeção de gases (GIS) para deposição de materiais, dispositivos de limpeza de amostras por plasma e criogênico, e detectores para espectroscopia de raios X dispersiva em energia (EDS) e difração de elétrons retroespalhados (EBSD). É um equipamento extremamente versátil que permite análises com altíssima resolução (XHR), nano fabricação, preparação de amostras ultrafinas para microscopia eletrônica de transmissão e reconstruções 3D por cortes sequenciais.
4 – Microscopia Confocal a Laser
Os microscópios confocais de varredura a laser funcionam usando um laser de onda contínua (Continuous Wave, CW) de comprimento curto de onda para promover uma luz de excitação de alta intensidade a fim de iluminar a amostra. Primeiramente, esse laser é refletido em um espelho dicroico e, em seguida, é refletido em outros dois espelhos responsáveis por fazer a varredura do laser em uma amostra corada. Quando excitado pelo laser, o corante na amostra fluorescente emite uma luz de comprimento longo de onda que passa por um processo inverso de varredura nos espelhos anteriormente usados para fazer a varredura da luz de excitação. Depois, a luz emitida passa pelo espelho dicroico, onde é focada em um pinhole e coletada e medida pelo detector. O detector está conectado a um computador que constrói uma imagem digital tridimensional ponto a ponto. Como o pinhole bloqueia qualquer fluorescência externa ao foco, a imagem resultante é altamente detalhada.
O feixe de laser de onda contínua, de comprimento curto, percorre um caminho óptico perfeitamente alinhado com o eixo óptico da objetiva, preenchendo toda a parte traseira da lente com luz. Desta forma a objetiva focaliza um volume limitado da amostra dado pela difração da luz na amostra gerando a iluminação pontual desejada. O diâmetro do ponto iluminado pelo laser varia de 0,25 a 0,8 micrômetros. Esta mesma objetiva coletará a luz emitida pelo agente fluorescente a partir deste ponto. Tanto a onda luminosa de excitação (luz laser transmitida através da amostra) quanto a emissão fluorescente passarão por um espelho dicróico (os espelhos dicróicos apresentam a propriedade de opacidade a determinados comprimentos de onda e transparência a outros). Em seguida, a luz emitida pelo agente fluorescente formará a imagem que está em plano focal conjugado (confocal) ao do ponto iluminado. Esta luz (emitida pelo agente fluorescente) deve passar por uma abertura confocal (o pinhole) colocado na frente do fotodetector, finalmente no fotodetector chegarão apenas os fótons que partiram do plano focal observado, os demais fótons que partiram de pontos focais diferentes estarão sujeitos a desvios em ângulos variados e serão barrados pelo pinhole, não contribuindo com a formação da imagem.
Geralmente os microscópios confocais apresentam um sistema de iluminação baseado em um laser de íon argônio (488 nm) que possibilita a excitação de inúmeros compostos fluorescentes (FITC, GFP, Alexa 488…). Outra linha de laser baseada ainda no íon argônio (514 nm) é utilizada para excitar determinadas moléculas como, por exemplo, a rodamina, sendo ainda comum encontrar o laser hélio-neônio (633) instalado na maioria dos equipamentos excitando fluoróforos que fluorescem no vermelho longo. Alguns equipamentos utilizam laser baseados no íon cryptonio capazes de excitar moléculas próximas à luz visível e dentro do espectro da luz ultravioleta.
As imagens formadas são do tipo mapa de pixels. Cada ponto capturado da imagem corresponde a um pixel na imagem final e desta forma o número de pontos por linha e o número de linhas definem a resolução física da imagem digitalizada.
Ela é utilizada para pesquisas com diversos espécimes vivos e fixados em estudos moleculares e celulares anatômicos, fisiológicos e bioquímicos em ciências da vida. A capacidade inata de segmentar a luz opticamente permite que os microscópios de varredura a laser realizem uma reconstrução precisa de estruturas 3D com alta resolução e alto contraste a partir de uma série de imagens obtidas em diferentes profundidades.
A microscopia confocal apresenta múltiplas vantagens em relação à microscopia óptica de campo amplo, entre elas a capacidade de controlar a profundidade do campo, a eliminação ou redução das informações de fundo para longe do plano focal (alta proporção entre sinal e ruído), além da capacidade de coletar cortes ópticos em série de espécimes espessos. O elemento básico para a abordagem confocal é o uso de técnicas de filtragem espacial visando eliminar a luz ou reflexo fora do foco em espécimes fora do campo de visão imediato.
A principal diferença entre a microscopia de varredura a laser e a microscopia eletrônica de varredura está no método de iluminação da amostra. Enquanto a microscopia de varredura a laser usa um ou mais lasers de excitação, a microscopia eletrônica de varredura, irradia a amostra com feixes de elétrons. Como a amostra precisa estar no vácuo, não é possível aplicar a microscopia eletrônica de varredura na observação de amostras vivas.
Um dos pontos de grande limitação da microscopia confocal é o número limitado de comprimentos de onda de excitação disponíveis para os sistemas de iluminação a laser sendo que alguns equipamentos apresentam um mínimo de combinações de comprimento de onda de excitação que limita bastante o seu uso. Microscópios que usam lâmpadas de mercúrio ou xenônio produzem um espectro de comrimento de onda luminosa muito mais amplo, desde o ultravioleta até regions próximas ao infra-vermelho.
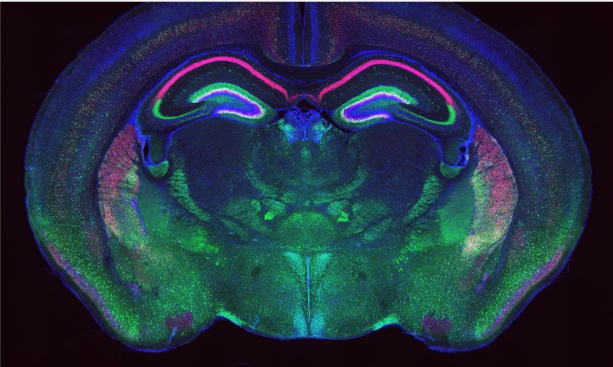
Mouse brain. (EVIDENT, acervo)

Microscópio confocal de varredura a laser para análise de materiais. (EVIDENT, acervo)
5 – Microscopia de Força Atômica (AFM)
A Microscopia de Força Atômica (AFM) é uma técnica poderosa utilizada em diversas áreas da ciência, incluindo a Química. Desde a sua invenção, tem permitido a visualização de superfícies em uma escala atômica, proporcionando uma compreensão detalhada das propriedades físico-químicas dos materiais. Esta técnica desempenha um papel crucial na investigação de micro e nanomateriais, influenciando significativamente avanços em tecnologia, medicina e ciência dos materiais. A Microscopia de Força Atômica foi desenvolvida em 1986 pelos cientistas Gerd Binnig, Calvin Quate e Christoph Gerber. O princípio básico da AFM envolve a utilização de uma sonda extremamente afiada, tipicamente feita de silício ou nitreto de silício, que varre a superfície da amostra. Esta sonda está montada em uma alavanca cantilever flexível e ao interagir com a superfície da amostra, ela é sensível às forças de repulsão e atração atômicas.
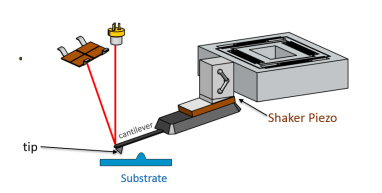
Os principais componentes de um microscópio de força atômica incluem um cantilever, uma sonda, um sistema de detecção e um scanner piezoelétrico. O cantilever é uma pequena alavanca flexível onde a sonda é montada. O sistema de detecção geralmente consiste em um laser que reflete na parte traseira do cantilever, medindo seu desvio à medida que a sonda interage com a superfície. O scanner piezoelétrico move a amostra ou a sonda em três dimensões com alta precisão.
A AFM tem uma ampla gama de aplicações, tornando-se uma ferramenta fundamental em várias disciplinas científicas e tecnológicas:
- Nanotecnologia: Na caracterização e manipulação de nanomateriais, a AFM é essencial para observar a morfologia e as propriedades físicas de estruturas na escala nanométrica. Isso inclui a fabricação de dispositivos nanoeletrônicos e nanomédicos.
- Ciência dos Materiais: Permite a análise detalhada das superfícies de materiais, incluindo polímeros, cerâmicas e metais, auxiliando no desenvolvimento de novos materiais com propriedades específicas.
- Biologia e Medicina: Utilizada para estudar a topografia de biomoléculas, células e tecidos, a AFM ajuda a entender processos biológicos em níveis moleculares e celulares.
- Química: Empregada para investigar reações químicas na superfície de materiais e para estudar a adsorção e a dessorção de moléculas em diferentes substratos.
Do ponto de vista tecnológico, a AFM facilita o desenvolvimento de dispositivos mais eficientes e miniaturizados, como transistores de efeito de campo, sensores e dispositivos médicos. Na área médica, por exemplo, a AFM é utilizada para estudar a elasticidade e a rigidez das células, auxiliando no diagnóstico de doenças. Desde a sua invenção, a AFM foi crucial em várias descobertas científicas. Um exemplo significativo é a visualização de moléculas de DNA, revelando sua estrutura helicoidal dupla. Outro avanço importante é a manipulação direta de átomos em uma superfície, realizada pela primeira vez em 1990, quando cientistas usaram um microscópio de força atômica para construir um logotipo composto por 35 átomos de xenônio.
6 – Microscopia e Flourescência de Excitação Multifotônica
A microscopia de fluorescência de excitação multifotônica (MFM) é uma técnica avançada que permite a visualização de estruturas celulares e tecidos em profundidade com alta resolução. Diferente da microscopia de fluorescência convencional, que utiliza um único fóton de alta energia para excitar fluoróforos, a MFM emprega dois ou mais fótons de menor energia simultaneamente, o que só ocorre no ponto focal do laser. Essa técnica minimiza o fotodano e a fotodegradação fora do plano focal, sendo especialmente útil para a análise de tecidos espessos e sensíveis. Além disso, a MFM possibilita a excitação de fluoróforos a profundidades maiores, oferecendo uma visão detalhada de estruturas biológicas em seus estados nativos e funcionais (DENK; STRICKLER; WEBB, 1990).

Configuração de microscópios de flourescência por excitação multifotônica. (EVIDENT, acervo).
A imagem mostra uma configuração típica para experimentos de microscopia de fluorescência multifotônica. O microscópio é montado verticalmente para observar tecidos vivos em pequenos animais. Ele utiliza um laser pulsado de titânio-safira para excitação multifotônica, devido à sua alta intensidade e baixa energia média. Um sistema de detecção de fotomultiplicador, próximo à objetiva, captura a fluorescência dispersa. As imagens digitais coletadas são processadas por uma estação de trabalho, permitindo a reconstrução tridimensional a partir dos cortes ópticos.
A metodologia é particularmente útil para profissionais da biologia celular que desejam estudar processos dinâmicos em células e tecidos vivos sem promover danos significativos (e muitas vezes letais) ao espécime. Embora o microscópio clássico de fluorescência de campo amplo costume ser capaz de fornecer resolução submicrônica de eventos bioquímicos em sistemas vivos, a técnica tem limitações em termos de sensibilidade e resolução especial devido ao ruído de fundo causado por fluorescências secundárias nas áreas situadas acima e abaixo do plano focal.
Na microscopia multifotônica, a excitação só ocorre no ponto focal de um microscópio limitado por difração, proporcionando a capacidade de particionar opticamente espécimes biológicos grossos a fim de obter uma resolução tridimensional. Cada corte óptico é adquirido mediante o escaneamento por varredura do espécime no plano x-y, enquanto uma imagem totalmente tridimensional é composta pelo escaneamento serial do espécime em posições z sequenciais. Como é possível determinar e controlar com exatidão a posição do ponto focal, a fluorescência multifotônica é útil para a sondagem das regiões selecionadas além da superfície do espécime. A energia de excitação altamente localizada serve para minimizar o fotobranqueamento dos fluoróforos vinculados ao espécime e reduz o fotodano, aumentando a viabilidade celular e a duração subsequente dos experimentos que pesquisam as propriedades de células vivas. Além disso, a aplicação de comprimentos de onda de excitação no intervalo do infravermelho próximo permite uma penetração superior nos materiais biológicos, além de reduzir o alto grau de dispersão da luz que é observado em comprimentos de onda mais curtos. Essas vantagens permitem que os pesquisadores conduzam experimentos em amostras grossas de tecido vivo, como cortes de cérebro ou cérebro vivo de animal in vivo e embriões em desenvolvimento, algo que seria difícil ou até impossível de capturar com outras técnicas de microscopia.
A aplicação da MFM em neurociência e bioimagem tridimensional tem revolucionado o campo da pesquisa biomédica. Em neurociência, a MFM é empregada para estudar a arquitetura complexa e a dinâmica de redes neuronais em tecidos cerebrais intactos, permitindo a observação em tempo real de processos como a sinaptogênese e a plasticidade neural. Essa capacidade de explorar as profundezas dos tecidos com alta resolução é crucial para a compreensão de doenças neurológicas e para o desenvolvimento de terapias inovadoras (SVOBODA; YASUDA, 2006). Na bioimagem tridimensional, a MFM permite a reconstrução de imagens 3D de células e tecidos, contribuindo para um entendimento mais completo da morfologia e da função celular, essencial para a pesquisa em áreas como a oncologia e a biologia do desenvolvimento (ZIPFEL; WILLIAMS; WEBB, 2003).
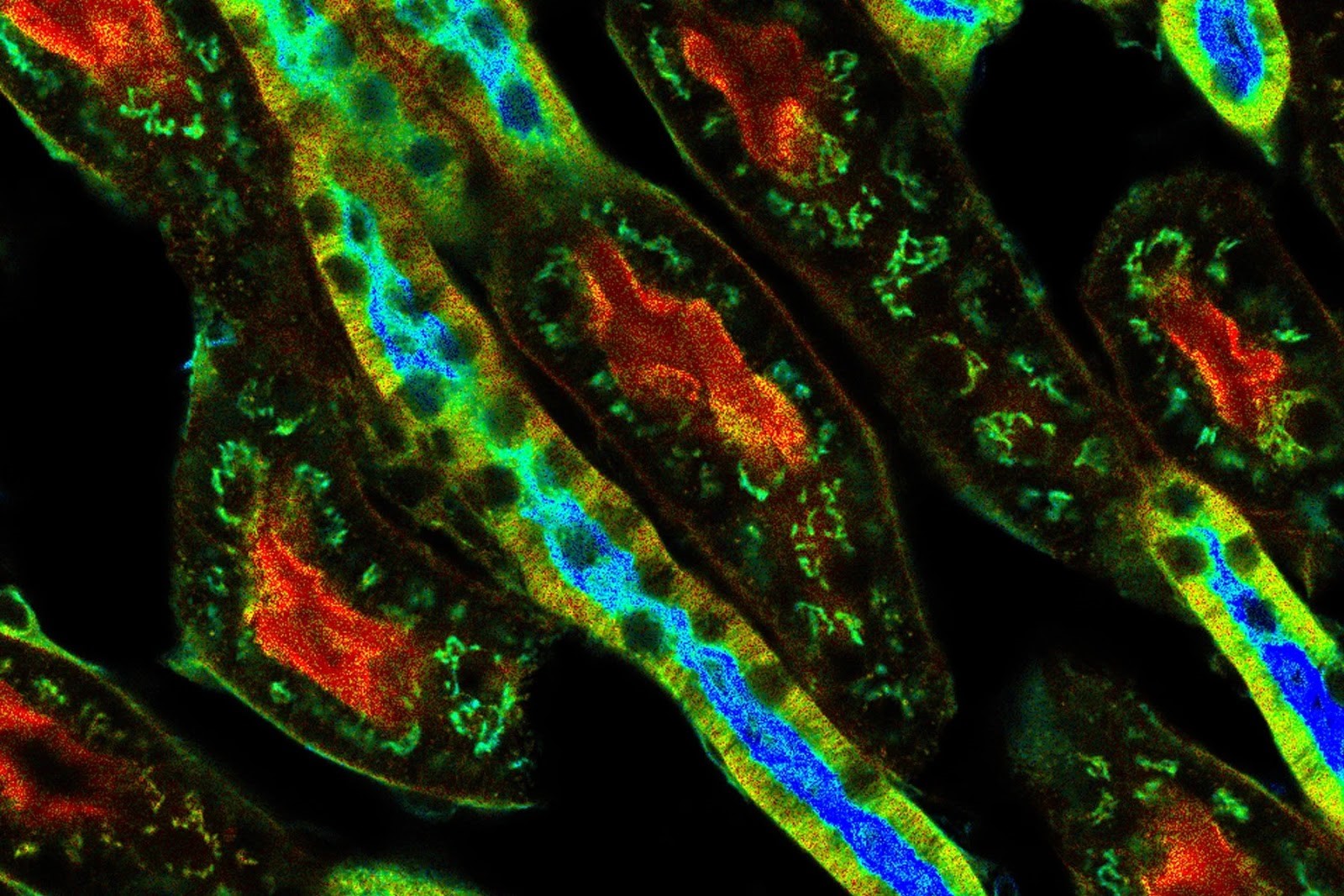
Gônodas hermafroditas adultas de C. elegans.
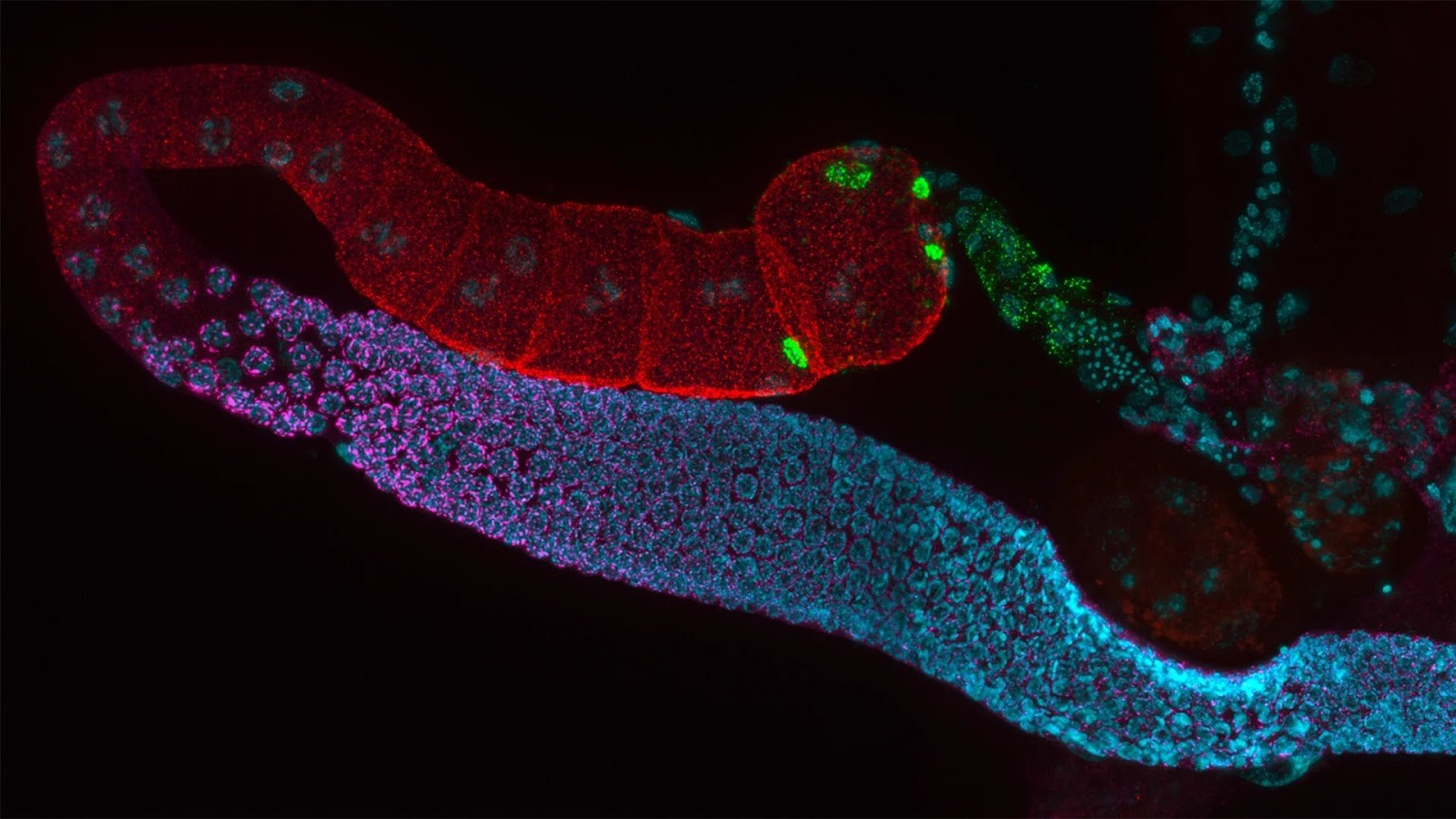
Microscopio Flourescente utilizando laser para excitar moléculas flourescentes presentes na amostra, criando assim uma imagem colorida. Esse tipo de microscópio permite a visuaização e estruturas específicas dentro da célula em alta resolução.
Referências
CORRÊA, J. et al. MICROSCOPIA CONFOCAL BÁSICA. Universidade de Brasília Microscopia Confocal Básica. Disponível em: <https://www2.ufjf.br/pgcbio/files/2018/10/Apostila.pdf>.
DENK, W.; STRICKLER, J. H.; WEBB, W. W. Two-photon laser scanning fluorescence microscopy. Science, v. 248, n. 4951, p. 73-76, 1990.
Introdução aos microscópios de varredura a laser | Olympus LS. Disponível em: <https://www.olympus-lifescience.com/pt/microscope-resource/primer/techniques/laser-scanning-microscopes-intro/#:~:text=Os%20microsc%C3%B3pios%20confocais%20de%20varredura%20a%20laser%20funcionam%20usando%20um>. Acesso em: 12 ago. 2024.
Laboratório de Microscopia Eletrônica de Varredura & Duplo Feixe. Disponível em: https://lnnano.cnpem.br/instalacoes-e-divisoes/divisao-de-nanomateriais/laboratorio-de-microscopia-eletronica-de-varredura-duplo-feixe/.Acesso em 18 de ago. 2024.
Microscópios de varredura a laser | Olympus LS. Disponível em: https://www.olympus-lifescience.com/pt/laser-scanning/. Acesso em: 12 ago. 2024.
Museu virtual de nanociência e nanotecnologia. Disponível em: https://www.maxwell.vrac.puc-rio.br/20312/historia_eletronicoDeVarredura6.html. Acesso em 18 ago. 2024.
PIRES, Carlos Eduardo de Barros M.; ALMEIDA, Lara Mendes de; COELHO, Alexander B. Microscopia: Contexto Histórico, Técnicas e Procedimentos para Observação de Amostras Biológicas. Rio de Janeiro: Grupo GEN, 2014. E-book.
RAMOS, Thaniele. Potencialidades da microscopia eletrônica (transmissão e varredura) e microscopia confocal como ferramentas para análises de amostras biológicas. 2013. 48 f. Trabalho de Conclusão de Curso de graduação – Universidade Federal do Rio Grande do Sul, Porto Alegre, 2013. Disponível em: https://lume.ufrgs.br/bitstream/handle/10183/96777/000919613.pdf. Acesso em: 13 ago. 2024.
SVOBODA, K.; YASUDA, R. Principles of Two-Photon Excitation Microscopy and Its Applications to Neuroscience. Neuron, v. 50, n. 6, p. 823-839, 2006.ZIPFEL, W. R.; WILLIAMS, R. M.; WEBB, W. W. Nonlinear magic: multiphoton microscopy in the biosciences. Nature Biotechnology, v. 21, n. 11, p. 1369-1377, 2003.

